élève de 2eme candi. chimie

Adresse e-mail:
Moro Sébastien
élève de 2eme candi. chimie

Adresse e-mail:
 Réactions
de Friedel-craft
Réactions
de Friedel-craft
Aimant la chimie j'ai décidé,
dans le cadre d'une réalisation d'une page web, de vous présenter
une réaction de chimie organique.
Charles Friedel:
chimiste et minéralogiste français (né à strasbourg
en 1832-décédé à montauban en 1899)
INTRODUCTION
L’alkylation et l’acylation sont deux réactions
dans lesquelles l’espèce électrophile est un carbocation
, et aboutissant à une liaison carbone-carbone. Elles sont souvent
appelée réaction de Friedel et Craft.
L’alkylation:
Substitution d’un H par un groupe alkyle R. Permet donc de lier une chaîne latérale sur un cycle. Elle résulte donc de la réaction entre un Hydrocarbure benzénique et un halogénure d’alkyle R-X,en présence de chlorure d’aluminium comme catalyseur.
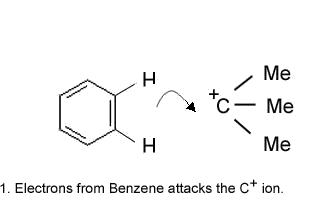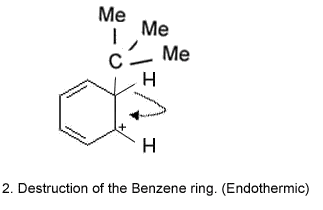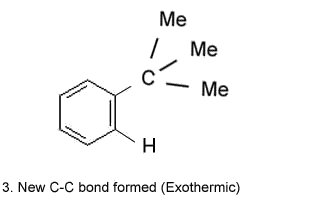
Voici l’action du catalyseur sur le liaison C-Cl et ensuite
la réaction du carbocation avec le cycle:
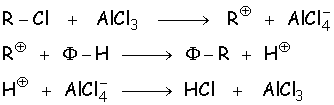
Overall Reaction

Generation of Carboncation (C
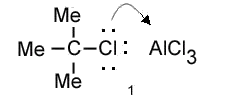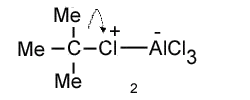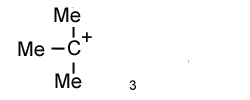
Mechanism of Alkylation (Me-Methyl group)
- Les avantages
de cette réaction : très intéressant
comme méthode de synthèse des hydrocarbures benzénique
à chaîne latérale.
- Les inconvénients : - il est difficile de limiter la réaction à la substitution d’un seul H
- le groupe alkyle ne se lie pas toujours au cycle par le carbone portant
l’halogène dans R-X. Comme avec le 1-chloropropane réagissant
majoritairement
avec le benzène pour donner de l’isopropylbenzène au lieu
du propylbenzène.
- Les halogénures d’aryles Ar-X ( par ex :chlorobenzène )
ne se prêtent
pas a cette réaction, on ne peut donc pas souder deux cycles benzénique
par cette méthode.
L’acylation :
Substitution d’un H par un groupe acyle R-CO ; on obtient
une cétone de la forme Ar-CO-R.
Par analogie avec l’alkylation cette réaction
résulte de la réaction d’un chlorure d’acide (R-CO-Cl) sur
un hydrocarbure benzénique , en présence de chlorure d’aluminium
favorisant la formation du carbocation R-C+=O (même principe qu’avec
l’halogénure d’alkyle)
![]()
Overall Reaction

Generation of Acylium cation

Mechanism of Acylation

Applications :
1. Les teintures doivent leur couleur à un groupe d'atomes particulier appelé chromophore. Les groupements chromophores des composés étant, à la ressemblance des fonctions, des groupements d'atomes responsables d'absorptions caractéristiques. Dans les colorants azoïques, le chromophore est constitué de noyaux aromatiques reliés entre eux par un pont formé de 2 atomes d'azote doublement liés (-N=N-). Le chromophore fait souvent partie d'un complexe arénique étendu, c'est-à-dire d'un système dans lequel des molécules aromatiques sont liées à un métal à travers un système d'électrons délocalisés.(voir formule comme ex.)
On ajoute des groupes fonctionnels interagissant avec le chromophore pour modifier ou améliorer la couleur d'une teinture, pour la rendre plus soluble, ou encore pour l'accrocher aux fibres du tissu. En essayant différents groupes fonctionnels, on peut fabriquer une très grande variété de colorations.
On fabrique ainsi des teintes synthétiques en ajoutant d'autres groupements chimiques (par exemple des groupements nitro (-NO2), amine (-NH2), ou des atomes d'un halogène comme le fluor, le chlore ou le brome) à un système aromatique lié à un groupement sulfonique. On procède à l'aide d'une série de réactions de type Friedel et Craft afin de lier un atome de carbone au cycle aromatique et débuter l'édification d'une chaîne latérale.
Le chlorure d'aluminium (catalyseur utilisé lors
d'une réaction de Friedel et Craft) augmente la polarisation d'une
liaison halogène-carbone dans une molécule organique et lui
permet ainsi de substituer à un atome d'hydrogène du cycle
aromatique. On utilise cette réaction pour aboutir soit à
une alkylation où un alkyle s'y substitue, soit à une acylation
pour laquelle un groupement acyle (RO-) est ajouté. Ces réactions
sont également d'un usage courant dans la chimie pour la synthèse
d'hydrocarbures et d'autres molécules organiques, ainsi que dans
la synthèse de plastiques comme le polystyrène.

2. Dans les hydrocarbures (synthèse de l’éthylbenzène) :
-La synthèse a lieu par alkylation du benzène par l'éthylène :
![]()
Cette réaction exothermique (DrH° = - 113,3
kJ/mol à 25°C) nécessite une catalyse par un acide de
Lewis. Les procédés les plus anciens utilisent le trichlorure
d'aluminium AlCl3, la réaction ayant lieu en phase gazeuse, à
180°C, sous une pression de 9 bar. Le taux de conversion est de l'ordre
de 40 à 45 %, l'éthylène et le benzène sont
recyclés après séparation et les dérivés
polyalkylés (diéthylbenzène (15 %)...) subissent une
reconversion (par transalkylation sur du benzène).
Nb : il existe maintenant des procédés
plus récents
-Synthèse du styrène :
![]()
Plus de 90 % de la production de styrène provient
de la déshydrogénation de l'éthylbenzène :
Nb : par polymérisation de cette molécule
on aura du polystyrène intervenant dans tous les produits plastique
(sac en plastique, pot de yaourt, emballage etc…)
ANNEXE :
-Voici la photo d'un chromophore
(plus pour la décoration qu'autre chose les atomes n'ayant pas été
spécifiés)
-Vous pouvez télécharger
le programme rasmol permettant de visualiser (.PDB) les molécules
en 3D : cliquez
ici
Voici la visualisation de l'acide acétique (vinaigre):



( page créée le 15/11/2001 )